
WD Stuart / iStock
İçindekiler
Periyodik Tablo Nasıl Keşfedildi?
Dimitri Mendeleyev periyodik tablonun ilk versiyonunu 150 yıl önce, 1 Mart 1869’da (miladi takvime göre)ortaya koymuştu. Bilinen 63 elementten oluşan periyodik tablonun bu taslak hali yıllar içinde birçok bilim insanının katkısıyla gelişti. Bugün atomu oluşturan parçacıklar ve elementlerin özellikleri hakkında çok daha kapsamlı bilgilere sahibiz. Ancak temelleri 150 yıl önce atılan, elementlerin özelliklerine göre sınıflandırıldığı periyodik tablonun temel yapısı kullanılmaya devam ediyor.
Element Nedir?

Greyfebruary / iStock
Altın, gümüş, cıva, demir, kurşun, kalay gibi elementler çok eski zamanlardan beri biliniyordu. Ancak modern kimyasal element kavramının temelini oluşturan tanım ilk kez 1661’de İngiliz kimyacı Robert Boyle tarafından yapıldı. Robert Boyle daha basit maddelere ayrıştırılamayan maddeleri element olarak tanımladı.
ElementlerPeriyodik Tabloda Nasıl Sınıflandırılıyor?
Elementleri sahip oldukları özelliklere göre sınıflandırmaya yönelik çalışmaların geçmişi 1800’lü yılların başına dayanıyor. 1829’da Alman kimyacı Johann Döbereiner bilinen elementlerin bir çoğunun üçlü gruplar şeklinde (örneğin lityum-sodyum-potasyum, kalsiyum-stronsiyum-baryum, kükürt-selenyum-tellür, klor-brom-iyot) ortak özellik gösterdiğine dikkat çekti ve elementleri bu şekilde sınıflandırdı. Döbereiner aynı zamanda aynı gruptaki elementlerin atom kütleleri arasında bir ilişki olduğunu fark etti: Elementler atom kütlelerine göre sıralandığında, birinci ve üçüncü elementin atom kütlelerinin ortalaması yaklaşık olarak ikinci elementin atom kütlesine eşitti. Bu sonuçlar diğer bilim insanlarını elementlerin özellikleri ile atom kütleleri arasındaki ilişkiyi anlama konusunda araştırmalar yapmaya teşvik etti.
1864’te kimyacı John Newlands elementleri atom kütlelerine göre sıraladığında, sekizinci elementin birinci elementle benzer özellikler gösterdiğini ve bu davranışın her sekiz elementte bir tekrar ettiğini buldu. Ancak Newlands’ın bu önermesi kalsiyum elementinden daha ağır elementler için gözlenmediğinden bilim dünyasında yaygın olarak kabul edilmedi.
1860’lı yıllarda Alman kimyacı Julius Meyer ve Rus kimyacı Dimitri Mendeleyev birbirlerinden bağımsız olarak elementlerin atom kütleleri ve özellikleri arasındaki ilişkiye göre sınıflandırılmasına yönelik çalışmalar yapıyordu. Her iki bilim insanı elementleri atom kütlelerine göre sıralayarak sınıflandırdıkları benzer iki tablo oluşturdu. Ancak Mendeleyev periyodik tablosunu 1869 yılında -Meyer’den bir yıl önce- yayımladı.
Mendeleyev’in Periyodik Tablosu

popovaphoto / iStock
Elementlerin özelliklerine göre sınıflandırıldığı tablonun adındaki “periyodik” ifadesi elementlerin belli aralıklarla yani periyodik olarak benzer özellikler göstermesinden kaynaklanıyor. Bu olgu “periyodik yasa” ve “periyodik sistem” olarak da isimlendiriliyor.
Mendeleyev, 1869’da yayımladığı periyodik tablonun ilk versiyonunda bilinen 63 elementi artan atom kütlelerine göre dikey olarak sıralamıştı. Benzer özellikteki elementler aynı gruplarda yer alıyordu ancak bu elementlerin bulunduğu gruplar periyodik tablonun bugünkü versiyonundaki gibi dikey değil yatay olarak düzenlenmişti.

Science Photo Library
Dimitri Mendeleyev’in 1869’da yayımladığı periyodik tablonun ilk versiyonu
Mendeleyev periyodik tablosunda elementleri atom kütlelerine göre sıraladığında, periyodik sisteme uymayan elementlerin yerlerinde değişiklikler yaptı. Örneğin atom kütlesine göre sıralandığında iyot (I) tellürün (Te) üstünde yer almalıydı. Ancak Mendeleyev bu iki elementin yerini değiştirdi. Böylece tellür benzer özelliklere sahip olduğu oksijen (O), kükürt (S) ve selenyum (Se) ile iyot ise benzer özelliklere sahip olduğu flor (F), klor (Cl) ve brom (Br) ile aynı grupta yer aldı.
Mendeleyev’in periyodik tablosunun ilk versiyonunda bazı elementler hatalı atom kütlelerine göre yerleştirilmişti. Ayrıca cıva (Hg), altın (Au), kurşun (Pb), talyum (Tl) gibi bazı ağır metallerin yerlerinde problem vardı.
Mendeleyev 1871’de periyodik tablosunun ikinci versiyonunu yayımladı. Periyodik tablonun bu versiyonunda benzer özellikler gösteren aynı gruptaki elementleri yatay olarak değil dikey olarak sıraladı. Mendeleyev elementleri aynı zamanda diğer elementlerle bileşikler oluştururken kurabilecekleri bağ sayısına göre de gruplandırdı.
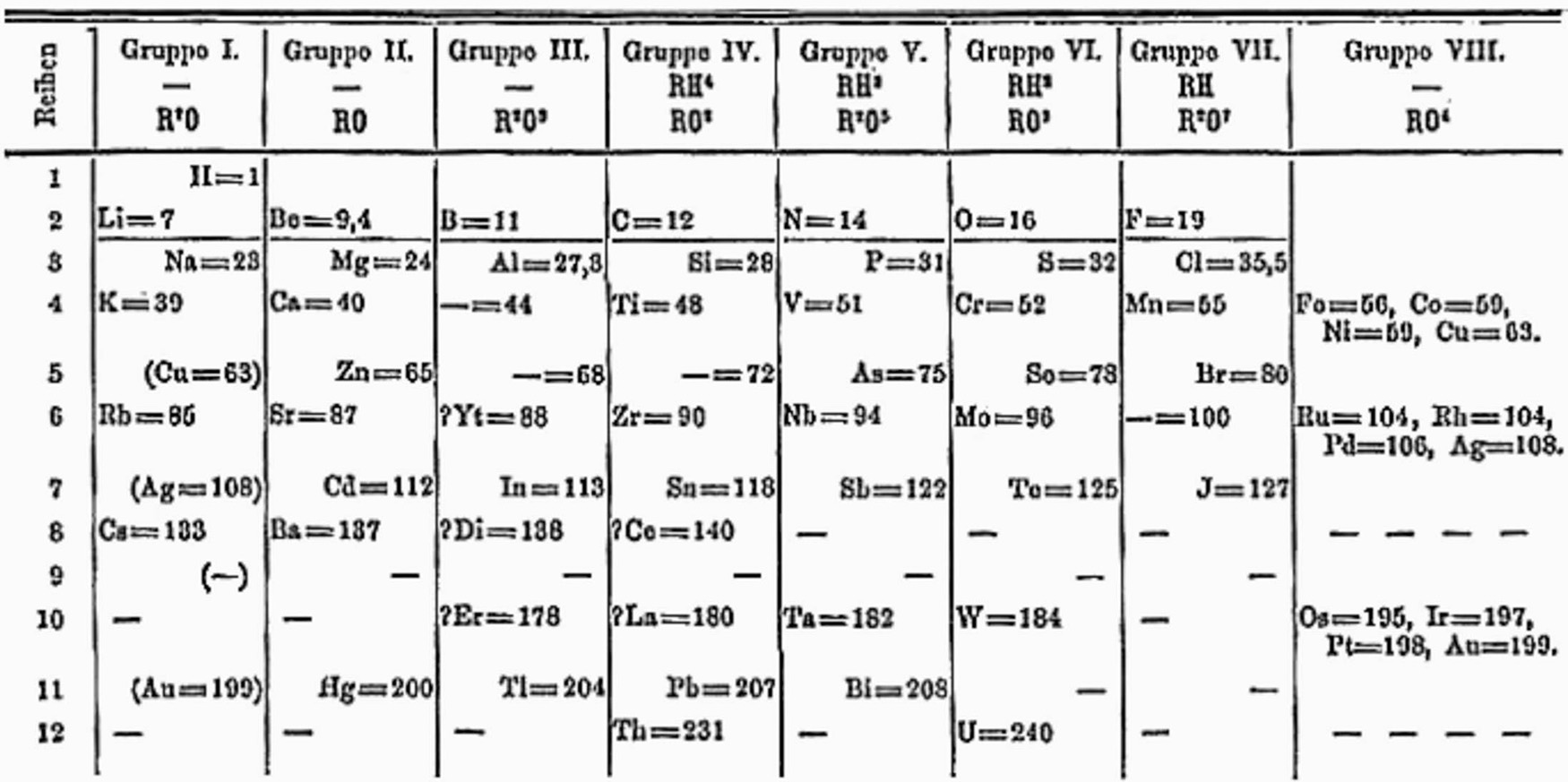
Alamy Stock Photo
Dimitri Mendeleyev’in periyodik tablosunun 1871’da yayımlanan versiyonu
Mendeleyev’in periyodik tablosunun en önemli özelliklerinden biri henüz keşfedilmemiş elementler için tabloda boşluklar bırakılmasıydı. Mendeleyev’in 1871’de yayımladığı makalede eka-alüminyum, eka-bor ve eka-silisyum adını verdiği bu elementler sırasıyla 1875, 1879 ve 1886 keşfedildi ve galyum (Ga), skandiyum (Sc) ve germenyum (Ge) olarak isimlendirildi. Mendeleyev henüz keşfedilmemiş bu elementlerin sadece atom kütlelerini değil başka özelliklerini de doğru tahmin etmişti. Örneğin Mendeleyev’in kütle numarasını 68, yoğunluğunu suyun altı katı olarak tahmin ettiği ve eka-alüminyum olarak isimlendirdiği element galyumun özellikleri ile (atom kütlesi 69,723, yoğunluğu ise 5,91 g/cm3) eşleşiyor. Mendeleyev’in periyodik tablonun 1871 versiyonunda yerini boş bıraktığı, kütle numarası 100 olan element 1937’de keşfedildi ve teknetyum olarak isimlendirildi.
Mendeleyev’in periyodik tablosunun ilk iki versiyonunda soygazlar bulunmuyordu. 1890’lı yıllarda soygazların keşfedilmesinden sonra Mendeleyev 1905 yılında soygazlar için periyodik tabloya yeni bir grup ekledi. Bugün geçiş metalleri olarak sınıflandırılan elementler ise tek bir grupta toplanmıştı.
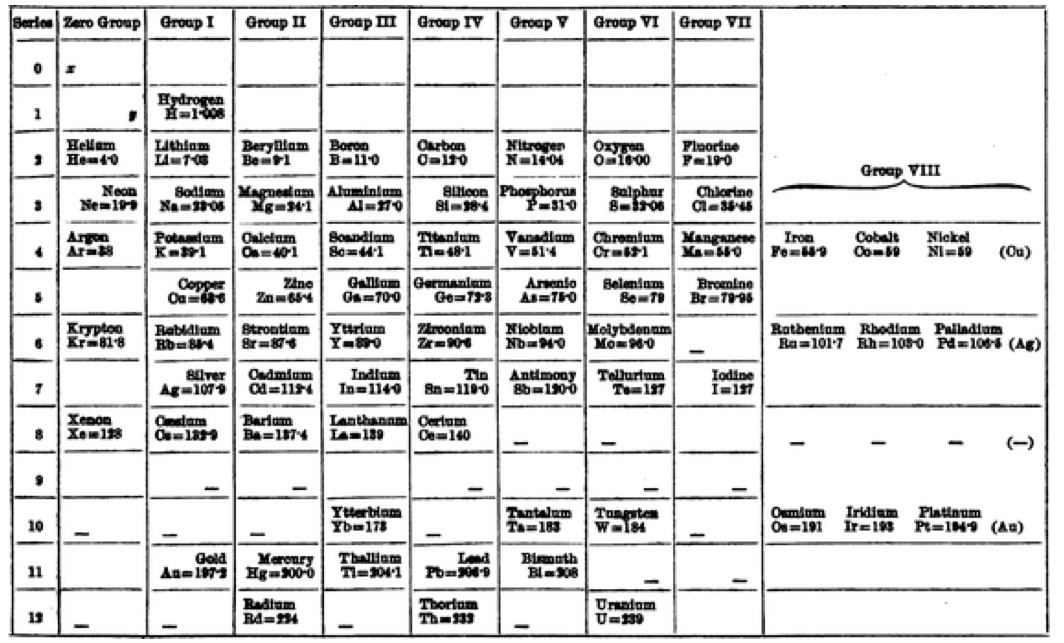
Dimitri Mendeleyev’in periyodik tablosunun 1905’te yayımlanan versiyonu
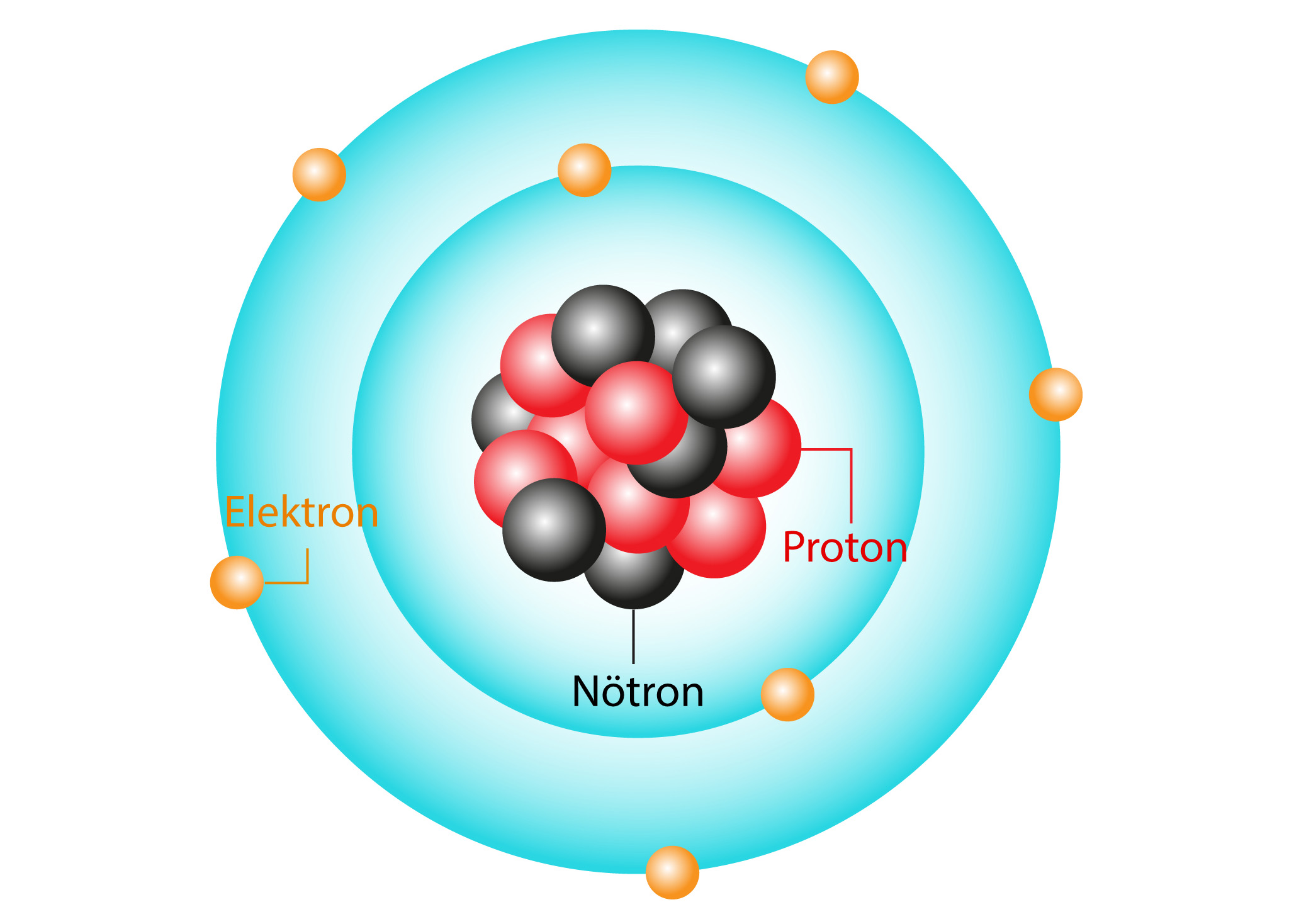
Periyodik tablonun ilk versiyonlarında elementler atom kütlelerine göre sıralanmıştı. Ancak elementlerin atom kütlelerine göre sıralanması periyodik tabloda atomların düzenlenmesinde bazı sorunlara yol açıyordu. Mendeleyev’in ölümünden altı yıl sonra İngiliz fizikçi Henry Moseley bir elementin kendine has kimyasal özelliklerinin atom numarası (bir atomun çekirdeğindeki protonların sayısı) tarafından belirlendiğini buldu. Bugün periyodik tabloda elementler atom numaralarına göre sıralanıyor.
Kamuran Ağbaba / iStock
Mendeleyev 1907’de hayatını kaybettiğinde atomun yapısı tam olarak anlaşılamamıştı. Bugün atomun proton, nötron ve elektrondan oluştuğunu biliyoruz. Atomun çekirdeği artı yüklü proton ve yüksüz nötronlardan oluşur. Eksi yüklü elektronlar ise çekirdek etrafında belirli enerji seviyelerindeki orbitallerde bulunur.

Bloomberg- Contributor / Getty Images
Fotoğrafta Kaliforniya Lawrence Livermore Laboratuvarı’ndaki bir araştırma sahası görülüyor.Kaliforniya Lawrence Livermore Laboratuvarı, yeni elementlerin keşfedilmesine yönelik araştırmaların gerçekleştirildiği laboratuvarlardan biri.
Mendeleyev’in periyodik tabloda bıraktığı boşluklarla ilgili yaptığı tahmin bilim insanlarına yeni elementler keşfetme konusunda ilham verdi. Bilinen 63 elementten oluşan periyodik tablonun ilk halinden sonra birçok element keşfedildi. Bugün periyodik tablo 118 elementten oluşuyor ve bilim insanları kararlı ve süperağır yeni elementler keşfetmeye yönelik araştırmalarına devam ediyor.
Periyodik tablodaki elementler ve özellikleri hakkında daha fazla bilgi edinmek isterseniz, Bilim Genç Periyodik Tablo sayfasını ziyaret edebilirsiniz.
Kaynaklar:
- http://www.rsc.org/periodic-table/history/about
- https://www.sciencenews.org/article/periodic-table-history-chemical-elements-150-anniversary
- https://www.nature.com/articles/s41557-018-0199-0
- https://chem.libretexts.org/Courses/Prince_Georges_Community_College/General_Chemistry_for_Engineering/Unit_1%3A_Atomic_Structure/Chapter_3%3A__The_Periodic_Table/Chapter_3.4%3A__The_History_of_the_Periodic_Table
- https://eic.rsc.org/feature/the-periodic-tables-of-mendeleev/2020258.article
- https://web.lemoyne.edu/giunta/EA/MENDELEEVann.HTML
- https://arxiv.org/abs/physics/0411080
- Stewart, P. J., “Mendeleev’s predictions: success and failure“, Foundations of Chemistry, 2018. https://doi.org/10.1007/s10698-018-9312-0
